ÉQUIPE REGPEP - DOMAINE DE COMPÉTENCE
Régulation Centrale de l’homéostasie énergétique et glucidique par le neuropeptide 26RFa (PI : Dr Marie Picot)
L'obésité et le diabète de type 2 (T2DM) sont des pathologies fortement associées. Ces deux pathologies sont considérées par l'Organisation Mondiale de la Santé comme un problème épidémique mondial et soulignent la nécessité de découvrir de nouvelles stratégies thérapeutiques pour la prévention ou le traitement de ces maladies. L'hypothalamus joue un rôle crucial à la fois dans le contrôle du comportement alimentaire et dans la régulation de l'homéostasie du glucose, et les systèmes neuropeptidergiques contrôlant ces deux régulations neuroendocriniennes sont en partie communs. Un nouveau concept a alors émergé selon lequel l'obésité et le diabète pourraient être dû à un dysfonctionnement des systèmes neuropeptidergiques contrôlant à la fois l'homéostasie de l'énergie et du glucose dans l'hypothalamus. Cependant, l'identité moléculaire de ces réseaux neuronaux peptidergiques reste mal connue.

Dans ce contexte, le système neuropeptidergique 26RFa/GPR103, identifié par l’équipe de N. Chartrel, présente un intérêt particulier. En effet, les neurones à 26RFa (Figure 1 et Vidéo) exercent d’une part, une activité orexigène robuste et, d’autre part, le 26RFa est un régulateur important de l'homéostasie du glucose à la périphérie via son activité incrétine soutenue.
Figure 1 et Vidéo: Les neurones de l’hypothalamus exprimant le neuropeptide 26RFa sont rendus fluorescents par l’expression ciblée d’un rapporteur Tomato, dans le cerveau de la souris (A, fluorescence rouge). Cela nous permet d’étudier la co-expression du 26RFa avec d’autres régulateurs du métabolisme (marqués en vert), dans les mêmes neurones (B, approche immunohistochimique utilisée pour déterminer l’identité moléculaire des neurones à 26RFa).
Nos études récentes portant sur le rôle central du 26RFa montrent que ce neuropeptide exerce un puissant effet antihyperglycémiant, similaire à celui produit par une administration centrale d’insuline, lorsqu’il est injecté au niveau central. De plus, l’effet central de l’insuline est partiellement bloqué par un antagoniste du GPR103 et aboli chez les souris mutantes pour le 26RFa. L’insuline régulerait notamment sa propre sécrétion périphérique via le système 26RFa/GPR103 central.
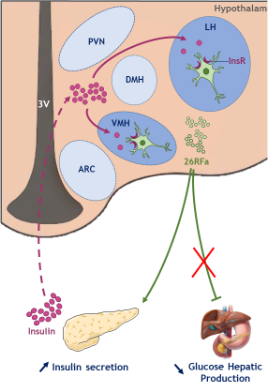
Ces résultats suggèrent que le système hypothalamique 26RFa/GPR103 est impliqué dans le réseau neuronal régulant l'homéostasie du glucose et serait un relais de l'insuline dans le cerveau (Figure 2), représentant ainsi une cible thérapeutique pour le traitement de l'obésité/T2DM.
Figure 2 : Le système 26RFa/GPR103 de l'hypothalamus est important pour le contrôle de la glycémie. Il constitue un relais de l'action centrale de l'insuline en médiant notamment l'action stimulante de cette hormone sur sa propre sécrétion par le pancréas. En revanche, il n'est pas impliqué dans la régulation centrale de la production hépatique de glucose.
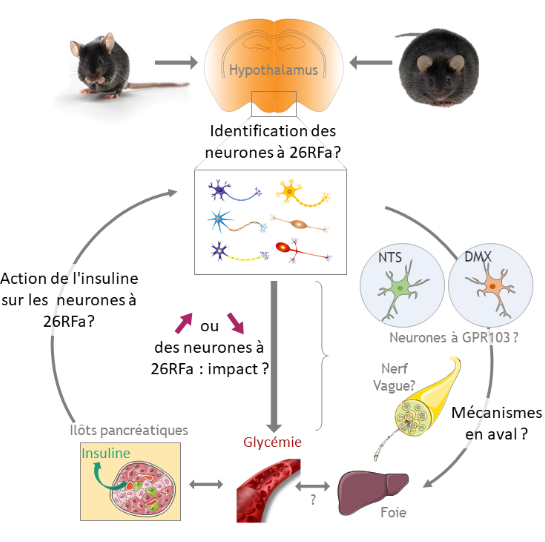
Cet axe de recherche s’articule autour de ces récentes découvertes et vise à (Figure 3) :
- Identifier les réseaux neuronaux auxquels appartiennent les neurones exprimant le 26RFa
- Décrire les systèmes neuropeptidergiques hypothalamiques interagissant avec le système 26RFa/GPR103
- Disséquer les mécanismes cellulaires et moléculaires impliqués dans la régulation centrale de l’homéostasie énergétique et glucidique par le 26RFa
- Étudier l’impact de la modulation du système 26RFa/GPR103 central dans des modèles murins obèses/diabétiques.
Figure 3 : Résumé graphique de l'axe de recherche portant sur la caractérisation du rôle du 26RFa dans la régulation centrale de la glycémie.
Pour ce faire, des techniques de pointe comme l’approche chémogénétique, l’hybridation in situ par RNAscope®, la microscopie 3D sur des cerveaux de souris rapportant l’expression du 26RFa (26RFaCRE ::tdTOMATO) ou déficientes en 26RFa sont mises en œuvre au laboratoire.
FINANCEMENTS OBTENUS
- Projet Jeune Chercheuse - Jeune Chercheur de l’Agence Nationale de la Recherche
- RIN Doctorant Région Normandie
- Financement Doctorant de l’INSERM
MEMBRES ACTUELS
- Marie Picot, Maitre de Conférences (marie.picot@univ-rouen.fr)
- Nicolas Chartrel, DR2 INSERM (nicolas.chartrel@univ-rouen.fr)
- Gaëtan Prévost, PU-PH (Gaetan.Prevost@chu-rouen.fr)
- Mélodie Devère, doctorante (melodie.devere@univ-rouen.fr)
- David Godefroy, Ingénieur d’Etude (david.godefroy@univ-rouen.fr)
- Saloua Takhlidjt, Technicienne (saloua.takhlidjt@univ-rouen.fr)
- Caroline Lusurier, étudiante en Master 2 Neurosciences, Université Claude Bernard Lyon 1 (caroline.lusurier@etu.univ-lyon1.fr)
- Amélie Lainé, étudiante en Master 2 Biologie Santé (amelie.laine@etu.univ-rouen.fr)
TECHNIQUES ET MODÈLES EXPÉRIMENTAUX
- Modulation de l’activité neuronale par chémogénétique (DREADD)
- Stéréotaxie
- Modèles de souris mutantes (constitutives et conditionnelles) pour le 26RFa
- Modèles de souris sous régime High-Fat
- Modèle de souris rapportrices 26RFaCRE::tdTOMATO
- Tests glycémiques (Tolérance au glucose, à l’insuline…)
- Enregistrements métaboliques
- Synthèse de peptides et d’analogues peptidiques
- Immunocytochimie, histologie
- Hybridation in situ RNAscope®
- Microscopie 2D (à fluorescence conventionnelle, confocale…) et 3D (microscopie à feuille de lumière)
- Dosages radioimmunologiques, immunoenzymatiques, Western-Blot
- Lignées cellulaires neuroendocrines (mHypoA)
- ARN interférence
- qPCR, RT-PCR
PRÉCÉDENTS MEMBRES
- Mouna El Mehdi, Doctorante. Actuellement post-doctorante au Max Planck Institute for Metabolism, Cologne, Allemagne
- Marie-Anne Le Solliec, Doctorante. Actuellement post-doctorante à l’IPMC, Nice, France

