ÉQUIPE REGPEP - DOMAINE DE COMPÉTENCE
Identification des partenaires moléculaires de la CgA dans la voie de sécrétion régulée (Maité Montero-Hadjadje)
Bien qu'il soit connu que nombre de pathologies (neuro)endocrines soient associées à une dérégulation de la sécrétion hormonale, suggérant ainsi une altération des mécanismes de sécrétion, les mécanismes moléculaires menant à cette dérégulation restent peu étudiés. Ainsi, l'objectif principal de notre recherche est d'identifier la machinerie moléculaire contrôlant la sécrétion (neuro)hormonale afin de comprendre l'impact de l'activité sécrétrice des cellules (neuro)endocrines sur l'initiation et/ou l'évolution des pathologies (neuro)endocrines, telles que l'obésité ou les maladies neurodégénératives, et ainsi imaginer de nouvelles pistes thérapeutiques.
Notre activité de recherche porte sur les mécanismes moléculaires contrôlant la sécrétion de (neuro)hormones dans des conditions physiologiques et physiopathologiques. Notre groupe focalise son attention sur l'identification d'acteurs moléculaires régulant la biogenèse des vésicules de sécrétion à cœur dense, organites impliqués dans le stockage et la libération de (neuro)hormones par les cellules (neuro)endocrines. Ces organites sont générés suite au bourgeonnement de la membrane du réseau trans-golgien (TGN), un compartiment cellulaire dans lequel les (neuro)hormones protéiques sont adressées vers les vésicules de sécrétion à cœur dense.
Nos études révèlent que (i) l'expression de la protéine soluble chromogranine A (CgA) dans les cellules non-endocrines induit la formation de structures sphériques délimitées par une membrane, partageant des caractéristiques morphologiques et fonctionnelles avec les vésicules de sécrétion à cœur dense, et (ii) que les régions terminales de la CgA sont cruciales pour l'adressage des hormones protéiques (Montero-Hadjadje et al., J Biol Chem 2009). Nous avons également démontré que le cytosquelette assure le transport de ces structures vésiculaires contenant la CgA à l'instar du transport des vésicules de sécrétion à cœur dense (Elias et al., Endocrinology 2012) et que le complexe acto-myosine est impliqué dans la biogenèse des vésicules de sécrétion (Figure 1) (Delestre-Delacour et al., Sci Rep 2017).
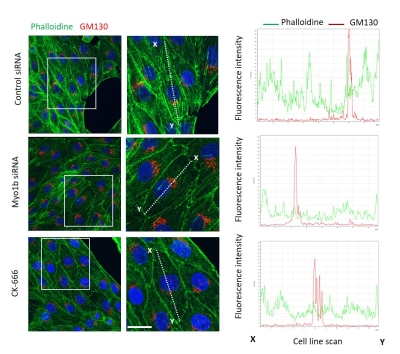
Figure 1. Observation en microscopie confocale de cellules COS-CgA dont l’expression de la myosine 1b (Myo1b) est altérée (utilisation de siRNA) ou traitées par un inhibiteur pharmacologique du complexe de nucléation de l’actine (CK666).
Dans une étude récente, nous avons recherché les partenaires moléculaires de la CgA requis au niveau de la membrane du TGN pour initier le bourgeonnement des vésicules de sécrétion à cœur dense. Ainsi, nous avons identifié au sein de la séquence de la CgA un domaine d'interaction avec l'acide phosphatidique (PA). Or, ce glycérophospholipide, bien que minoritaire au sein des membranes biologiques, est impliqué dans des phénomènes de courbure membranaire en cas d'accumulation. A l'aide de modèles de liposomes géants, et de techniques de vidéomicrocopie et de microscopie à force atomique, nous avons pu mettre en évidence la capacité de la CgA à recruter les molécules de PA et ainsi remodeler les membranes (Figure 2 et 3 ; vidéos 1 et 2). Par ailleurs, la surexpression de la CgA dépourvue de la séquence d'interaction avec le PA dans des cellules neuroendocrines entraîne une diminution significative du nombre de vésicules de sécrétion. Enfin, à l'aide de la microscopie électronique, nous avons pu observer un nombre réduit et une malformation des vésicules de sécrétion au sein des cellules chromaffines de souris dont le gène de la phospholipase D1 (impliquée dans la synthèse du PA) est invalidé (Figure 4) (Carmon et al., FASEB J 2020), phénotype se rapprochant de celui des souris dont le gène de la CgA est invalidé. Ces observations suggèrent un lien entre CgA et PA dans la biogenèse des vésicules de sécrétion.

Figure 2. Observation en microscopie confocale de déformations de la membrane d’un liposome géant enrichi en PA (vert) suite à l’ajout de CgA (rouge).
Vidéo 1. Observation à l’aide de la microscopie confocale de la déformation et du bourgeonnement de la membrane de liposome géant (vert) contenant du PA suite à l’ajout de CgA.
Vidéo 2. Reconstitution en 3D d’un liposome géant contenant du PA (vert) suite à l’ajout de CgA (rouge). Les zones jaunes correspondent à une superposition du PA et de la CgA.

Figure 1. Observation en microscopie confocale de cellules COS-CgA dont l’expression de la myosine 1b (Myo1b) est altérée (utilisation de siRNA) ou traitées par un inhibiteur pharmacologique du complexe de nucléation de l’actine (CK666).

Figure 2. Observation en microscopie confocale de déformations de la membrane d’un liposome géant enrichi en PA (vert) suite à l’ajout de CgA (rouge).
.png)
Figure 3. Analyse à l’aide de la Microscopie à Force Atomique de la topographie de la surface de membrane de liposomes géants enrichis ou non en acide phosphatidique (POPA) suite à l’ajout de chromogranine A (CgA). L’ajout de CgA augmente le nombre, l’aire et la hauteur de microdomaines (encarts en pointillés), ce qui suggère une interaction entre la CgA et le PA à l’origine d’un remodelage membranaire.
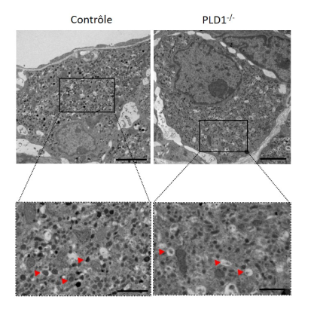
Figure 4. Observation en microscopie électronique à transmission de cellules chromaffines de souris sauvages (contrôle) et KO PLD1 (PLD1-/-). Les encarts sont des agrandissements des cellules montrant que les granules de sécrétion (flèches rouges) sont moins nombreux et déformés suite à l’inhibition de l’expression de la PLD1, enzyme impliquée dans le métabolisme du PA.
.png)
Figure 3. Analyse à l’aide de la Microscopie à Force Atomique de la topographie de la surface de membrane de liposomes géants enrichis ou non en acide phosphatidique (POPA) suite à l’ajout de chromogranine A (CgA). L’ajout de CgA augmente le nombre, l’aire et la hauteur de microdomaines (encarts en pointillés), ce qui suggère une interaction entre la CgA et le PA à l’origine d’un remodelage membranaire.

Figure 4. Observation en microscopie électronique à transmission de cellules chromaffines de souris sauvages (contrôle) et KO PLD1 (PLD1-/-). Les encarts sont des agrandissements des cellules montrant que les granules de sécrétion (flèches rouges) sont moins nombreux et déformés suite à l’inhibition de l’expression de la PLD1, enzyme impliquée dans le métabolisme du PA.
Vidéo 1. Observation à l’aide de la microscopie confocale de la déformation et du bourgeonnement de la membrane de liposome géant (vert) contenant du PA suite à l’ajout de CgA.
Vidéo 2. Reconstitution en 3D d’un liposome géant contenant du PA (vert) suite à l’ajout de CgA (rouge). Les zones jaunes correspondent à une superposition du PA et de la CgA.
.png)
Figure 3. Analyse à l’aide de la Microscopie à Force Atomique de la topographie de la surface de membrane de liposomes géants enrichis ou non en acide phosphatidique (POPA) suite à l’ajout de chromogranine A (CgA). L’ajout de CgA augmente le nombre, l’aire et la hauteur de microdomaines (encarts en pointillés), ce qui suggère une interaction entre la CgA et le PA à l’origine d’un remodelage membranaire.

Figure 4. Observation en microscopie électronique à transmission de cellules chromaffines de souris sauvages (contrôle) et KO PLD1 (PLD1-/-). Les encarts sont des agrandissements des cellules montrant que les granules de sécrétion (flèches rouges) sont moins nombreux et déformés suite à l’inhibition de l’expression de la PLD1, enzyme impliquée dans le métabolisme du PA.
Vidéo 1. Observation à l’aide de la microscopie confocale de la déformation et du bourgeonnement de la membrane de liposome géant (vert) contenant du PA suite à l’ajout de CgA.
Vidéo 2. Reconstitution en 3D d’un liposome géant contenant du PA (vert) suite à l’ajout de CgA (rouge). Les zones jaunes correspondent à une superposition du PA et de la CgA.
Ainsi, à l'heure actuelle, nous recherchons à mettre en évidence cette interaction CgA/PA au sein des cellules vivantes à l'aide de sondes de PA fluorescentes biocompatibles néosynthétisées dans le cadre d'une collaboration avec l'équipe locale de chimistes organiciens du Pr PY Renard (COBRA UMR 6014 CNRS). En effet, à l'aide de la surexpression de la CgA couplée avec une protéine fluorescente adéquate et suite à son excitation, nous analyserons l'interaction entre CgA et PA au sein de la cellule neuroendocrine vivante en suivant le transfert d'énergie vers le PA fluorescent à l'aide de la technique de FRET et de la microscopie de super-résolution STED couplée à un module FLIM, en collaboration avec le Dr Magalie Bénard (PRIMACEN, Unité Heracles). Le cas échéant, nous serons dans la capacité de déterminer au niveau de quelles membranes cette interaction aura lieu.
Par ailleurs, à l'aide de la microscopie à ondes évanescentes (TIRFM) (Vidéo 3), nous avons pu observer que la surexpression de la CgA dépourvue du domaine d'interaction avec le PA entraîne une modification des paramètres cinétiques de l'exocytose, avec un temps de libération raccourci ce qui suggère que la CgA, via son interaction avec le PA, régule la quantité de molécules libérées. Afin de vérifier cette hypothèse, dans le cadre de notre collaboration avec l'équipe du Dr Nicolas Vitale (INCI, UPR 3212 CNRS, Strasbourg), nous analysons l'impact de la surexpression de la CgA dépourvue du domaine d'interaction avec le PA dans les cellules chromaffines sur la libération de catécholamines à l'aide de la technique d'ampérométrie. Parallèlement, à l'aide de la microscopie à force atomique, nous étudions et comparons l'implication de la CgA dans la formation des pores de fusion lors de l'exocytose des vésicules de sécrétion de cellules chromaffines saines et dont la synthèse du PA est altérée, en collaboration avec le Dr Stéphane Alexandre (PBS UMR 6270 CNRS, Mont-Saint-Aignan).
Vidéo 3. Observation à l’aide de la microscopie à ondes évanescentes (TIRF-M) d’une cellule vivante exprimant la CgA-GFP, après stimulation. Les vésicules de sécrétion contenant la CgA-GFP apparaissent en vert et les flashes de fluorescence correspondent à des évènements d’exocytose.
Vidéo 3. Observation à l’aide de la microscopie à ondes évanescentes (TIRF-M) d’une cellule vivante exprimant la CgA-GFP, après stimulation. Les vésicules de sécrétion contenant la CgA-GFP apparaissent en vert et les flashes de fluorescence correspondent à des évènements d’exocytose.
A l'échelle de l'organisme, de manière très intéressante, les souris dont le gène de la CgA a été invalidé présentent une hypertension artérielle en lien avec un taux circulant augmenté de catécholamines ainsi qu'une obésité. Dans l'optique d'identifier le rôle de la CgA dans le contrôle central du métabolisme, nous avons entrepris d'utiliser des souris dont le gène de la CgA pourra être invalidé de manière ciblée dans certaines populations de neurones hypothalamiques.
FINANCEMENTS OBTENUS
- RIN Emergent Région Normandie
- France-Biolmaging
- Fondation pour la recherche Médicale
- Agence Nationale de la Recherche
MEMBRES ACTUELS
- Maite Montero-Hadjadje, Professeure des Universités (maite.montero@univ-rouen.fr)
- Lydie Jeandel, Maître de Conférences (lydie.jeandel@univ-rouen.fr)
- Thomas Ferrand, doctorant (thomas.ferrand1@univ-rouen.fr)
- Amélie Lainé, étudiante en Master 1 Biologie Santé (amelie.laine@etu.univ-rouen.fr)
TECHNIQUES ET MODÈLES EXPÉRIMENTAUX
- Culture primaire de cellules chromaffines
- Lignées cellulaires neuroendocrines (COS7-CgA, PC12, mHypoA)
- Souris CgA-floxée
- Liposomes, liposomes géants
- Immunocytochimie, histologie, transfection cellulaire (agents lipofectants, électroporation, virus)
- Microscopie (à fluorescence conventionnelle, confocale, à ondes évanescentes, vidéomicroscopie, à force atomique, à feuille de lumière, super-résolution gated-STED)
- Dosages radioimmunologiques, immunoenzymatiques, Western-Blot
- ARN interférence
- Clonage et sous-clonage, mutagenèse dirigée
- qPCR, RT-PCR
- Synthèse de protéines recombinantes
PRÉCÉDENTS MEMBRES
- Angélie Wagner, étudiante en Master 2 Biologie-Santé (angelie.wagner@etu.univ-rouen.fr)
- Marine Courvalet, Ingénieure d’études, actuellement Chargée Qualification/Validation chez Consultys, Louviers
- Lina Riachy, Post-Doctorante, actuellement à , USA
- Fanny Laguerre, doctorante, actuellement Design Operations Leader chez Sanofi, Rouen
- Ophélie Carmon, doctorante, actuellement Chargée de Qualification et Validation at Altran for Sanofi, Rouen
- Maïté Courel, Post-Doctorante, actuellement Maître de Conférences à l’Université Paris Sorbonne
- Charlène Delestre-Delacour, doctorante, actuellement Enseignante/Formatrice, Chargée de projet en Médiation par l’animal, Rouen
- Salah Elias, doctorant, actuellement Maître de Conférences à l’Université de Southampton (UK)

